對人臍靜脈內皮細胞中血管內皮細胞生長
因子受體的酪氨酸磷酸化抑制作用:一種具有血管新生抑制效果的鲨魚肉萃取物
Lan Yuan1, In-Sook Ahn2 and Paul F. Davis1
- Bioactivity Investigation Group, Wellington School of Medicine and Health Science, Wellington, New Zealand.
- Department of Food Science and Nutrition, Pusan National University, Pusan, Republic of Korea
前言
血管新生指的是新的毛細血管的生成過程、這個過程取決于血管新生誘導因子和其受體間的的相互作用1。 血管內皮細胞生長因子(VEGF)和其受體在血管新生過程中起著關鍵作用2。 當VEGF與其細胞表面受體(酪氨酸激酶家族、如VEGF受體-2(KDR)和VEGF受體-1(Flt-1))相結合時3–5、 它誘導了內在細胞質的酶活性、促進了蛋白質基質內ATPg-磷酸向酪氨酸殘基的轉化。 這個信號傳達促進了血管細胞分裂、進而加速了血管新生2。 阻礙VEGF與其受體的結合是抑制血管新生的一種重要的醫療方法。 目前已經出現了多種針對VEGF受體信號通道的抗癌療法6。 鲨魚軟骨因爲其抑制血管新生作用、被認爲是一種抗癌制劑。 我們先前的體內試驗顯示口服鲨魚軟骨粉抑制了血管新生7。 後續未發表的研究發現鲨魚肉和脊髓的乙醇萃取物具有比鲨魚軟骨粉更強的血管新生抑制作用。 最近、我們發現幹燥的鲨魚肉乙醇萃取物和橄榄油的混合物(shark muscle–olive oil、SMO)有強效的血管新生抑制作用、 這種作用也許可以在無細胞體系中阻礙VEGF與其受體的結合8。 然而、SMO是否可以對血管內皮細胞或癌症細胞中的VEGF受體有類似作用目前還不得而知。 爲了進一步調查SMO是否能阻礙VEGF與其受體的結合、我們使用了人臍靜脈內皮細胞(HUVEC)、 它可以表達VEGF受體9、試驗目的是通過VEGF受體內酪氨酸殘基的磷酸化改變、研究SMO是否能阻礙VEGF與其受體的結合。材料和方法
試劑
重組人血管內皮生長因子、抗VEGF受體-1單抗(Flt-1)、 抗VEGF受體2單抗(KDR)、抗小鼠IgG)、全血清寒天、 內皮細胞生長添加劑、細胞溶解檢測試劑盒、sodium orthovanadate、牛血清白蛋白、 和噻唑蘭MTT(thiazolyl blue tetrazolium bromide)購于Sigma Chemical Co. (St. Louis, MO)。 抗酪氨酸磷酸化單抗和 辣根過氧化酶結合的羊抗鼠IgG 購于 R&D Systems (Minneapolis, MN)。 免疫印迹試驗化學發光試劑和 Hyperfilm ECL購于Amersham Biosciences Pty Ltd. (Sydney, NSW, Australia)。 聚丙烯酰胺凝膠電泳所需的試劑和設備的供貨商是Bio-Rad Laboratories (Hercules, CA)。 Immobilon 膜來自于Millipore Corp. (Bedford, MA)。 本試驗中用到的 SMO 混合物是由Aotea Pacific Ltd. (Auckland, New Zealand)提供的。 這個富含脂質的混合物(鲨魚肉油萃取物–橄榄油、9:1 [vol/vol])是在酒精濃度爲20%的20mg/mL試劑中制備的、儲藏溫度爲-20°C。細胞系
人臍靜脈內皮細胞(HUVECs)采購自the American Type Culture Collection (Manassas, VA)。 這些細胞在Ham's F12K medium(Sigma)培養、並添加0.03mg/mL內皮細胞生長添加劑和10%胎牛血清(Sigma)。細胞增殖測試
將每等份(100µL)的人臍靜脈內皮細胞(1×105/mL)分別放入96孔微板的各孔。 將SMO加入相對應的孔、使其最終濃度爲0, 10, 50, and 100µg/mL。 同時加入VEGF(50 ng/mL 最終濃度)。 這些細胞被放入95% air/5% CO2 孵箱培養48小時、溫度是37°C。 培養後、加入10µL噻唑蘭MTT(thiazolyl blue tetrazolium bromide, 溶解于5 mg/mL磷酸鹽緩沖液)、再培養4小時、溫度爲37°C。 然後、在各孔加入100微升裂解液(10%十二烷基硫酸鈉/45% 二甲基甲酰胺, pH 4.7)、再培養4小時、溫度爲37°C。 微孔讀數儀顯示每孔吸收率是570 nm10。細胞裂解液的制備11
當人臍靜脈內皮細胞在直徑100mm的細胞培養皿中培養到80–90%時、將細胞在含0.1%胎牛血清的培養基中進行血清饑餓。 在磷酸鹽緩沖液中用100nM磷酸酯酶抑制劑預處理30分鐘後、將這些細胞放入含VEGF(50ng/mL)的各種濃度SMO中再培養30分鐘。 用冰冷的磷酸鹽緩沖液(含10mM EDTA, 2 mM sodium fluoride和2mM sodium orthovanadate)沖洗這些細胞、 然後用細胞裂解試劑(1×106–5×106 細胞/mL冷裂解液試劑)裂解細胞。 在4°C晃動30–60分鐘這些萃取物混合液。然後在3,000g和 4°C進行離心裂解液5分鐘。 用蛋白含量測定試劑盒(Bio-Rad)確定這些細胞裂解的蛋白質含量。免疫復合體的制備
用10µL含50%抗小鼠IgG寒天磁珠的混懸液在冰上和1毫升細胞裂解液預培養5分鐘。 然後將混合液體在3,000g和4°C離心0.5分鐘、沈澱懸珠、然後將上清液轉移到新的試管。重復此步驟。 抗小鼠IgG寒天磁珠在加入溶解液之前要先用清洗緩沖液(20mM Tris HCl [pH 8.0], 0.15 M NaCl, 2 mM EDTA, 1% Nonidet P-40, 10% glycerol, and 1 mM sodium orthovanadate)清洗抗小鼠IgG 寒天磁珠三次。免疫沈澱反應
將5µL的小鼠抗磷酸化酪氨酸抗體加入500µL細胞裂解液(約1mg/mL蛋白質)中、然後在4°C晃動混合液16小時。 然後、再加入20µL抗小鼠IgG寒天磁珠(50%懸浮液)、再在4°C進壹步晃動混合液2小時。 然後將這個被抗小鼠IgG所吸附的免疫復合物液體在3,000g和4°C離心0.5分鐘、沈澱含免疫復合物的懸珠、再用緩沖液漂洗後巴斯德吸管將沈澱物再懸浮、最後再離心沈澱懸珠。 用漂洗緩沖液總共漂洗沈澱物三次、然後加50µL磷酸鹽緩沖液稀釋、然後被移到新的的試管作最後離心。 用50µL of 2µ SDS Gel Sample Buffer(250 mM Tris [pH 6.8], 6% SDS, 10% glycerol, 10 mM sodium fluoride, and bromophenyl blue)對漂洗後的免疫懸珠復合物通過震動懸浮進行溶解、再懸浮、然後在恒溫水浴中培養3分鐘使免疫復合物從磁珠上脫離。 把抗小鼠IgG寒天磁珠通過離心去除、然後收集上清液(含免疫復合物)並存放在-20°C、等候免疫印跡試驗。免疫印跡試驗
根據不同的分子量準備不同的分子標準。 制備好SDS-聚丙酰胺凝膠中不同濃度的丙烯酰胺: 10%用於磷酸化酪氨酸、8%用於VEGF受體-1和6%用於VEGF受體-2。 使用預先染色的SDS-聚丙酰胺凝膠電泳廣泛範圍標準(catalog number 161-0318, Bio-Rad)來作分子標記。 使用10微升的預制標本、在200V中電泳45分鐘(5.5mA/cm2)、使用轉寫裝置(Trans-Blot®SD Semi-Dry Electrophoretic Transfer Cell, Bio-Rad)30分鐘後、凝膠中的被分離的免疫復合物的各種分子被電泳轉移至PVDF膜。 用20mL漂洗緩沖液(0.1% Tween 20 in PBS)漂洗膜5分鐘、然後用20mL封閉緩沖液(0.1% Tween 20 in PBS with 5% bovine serum albumin) 封閉膜60分鐘。 然後在4°C、將膜放入相應的抗體溶液(monoclonal anti-phosphotyrosine antibody [1.0 µg/mL]、anti-VEGF receptor-1 [1:500], 和 monoclonal anti-VEGF receptor-2 antibody [1:800])晃動壹夜培養、此抗體溶液溶解於0.1% Tween 20 磷酸鹽緩沖液(含5%牛血清白蛋白)。 用20mL漂洗緩沖液漂洗膜5分鐘、重復5次。 然後、在第二種抗體溶液(horseradish peroxidase- conjugated goat anti-mouse IgG) (1:2,000 dilution)室溫環境下再培養膜壹個小時. 用20 mL漂洗緩沖液漂洗膜5分鐘、總共7次。 用免疫印跡化學發光試劑(Amersham Biosciences)測試該復合體、然後在X-光暗盒中曝光(Hyperfilm ECL, Amersham Biosciences) 2–10分鐘。數據分析
用電腦軟件(Prism version 4.0a, Graph Pad Software, San Diego, CA)對人臍靜脈內皮細胞的細胞增殖數據進行分析。 各組數據與VEGF-陽性對照組進行比較、在方差分析上、與VEGF-陽性對照組數據差異很大。 數據分值用means ± SD表示。結論
SMO對於人臍靜脈內皮細胞中的VEGF加強細胞增殖的抑制作用
為了調查SMO對於人臍靜脈內皮細胞增殖的作用、對細胞進行血清饑餓24小時、然後在含10%胎牛血清的培養基(有些培養基有VEGF (50 ng/mL)、有些沒有)中培養48小時、SMO的濃度不同(0, 10, 50, and 100 µg/mL)。 如圖1所示、在VEGF陽性對照組中、與未處理細胞相比、VEGF處理細胞增強了人臍靜脈內皮細胞的增殖。 在各濃度(10, 50, and 100 µg/mL)(圖. 1)情況下、SMO 處理都抑制了人臍靜脈內皮細胞的增殖。
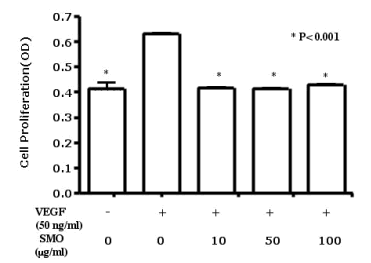 使用或未使用VEGF對人臍靜脈內皮細胞(1µ105/mL)進行培養48小時、SMO樣本的濃度不同(0, 10, 50, and 100 µg/mL)。
用MTT assay 方法對細胞增殖進行量化。
數據結果比較的是VEGF陽性對照組(50 ng/mL VEGF, 無SMO 處理)、無VEGF和無SMO處理對照組、和VEGF處理組(50ng/mL)、及三種不同濃度的SMO(10, 50, and 100 µg/mL)。
用方差分析來分析數值是否有意義。所有數值用 means ± SD來表示. *P < 0.001. OD, 光密度.
使用或未使用VEGF對人臍靜脈內皮細胞(1µ105/mL)進行培養48小時、SMO樣本的濃度不同(0, 10, 50, and 100 µg/mL)。
用MTT assay 方法對細胞增殖進行量化。
數據結果比較的是VEGF陽性對照組(50 ng/mL VEGF, 無SMO 處理)、無VEGF和無SMO處理對照組、和VEGF處理組(50ng/mL)、及三種不同濃度的SMO(10, 50, and 100 µg/mL)。
用方差分析來分析數值是否有意義。所有數值用 means ± SD來表示. *P < 0.001. OD, 光密度.
為了調查SMO對於人臍靜脈內皮細胞增殖的作用、對細胞進行血清饑餓24小時、然後在含10%胎牛血清的培養基(有些培養基有VEGF (50 ng/mL)、有些沒有)中培養48小時、SMO的濃度不同(0, 10, 50, and 100 µg/mL)。 如圖1所示、在VEGF陽性對照組中、與未處理細胞相比、VEGF處理細胞增強了人臍靜脈內皮細胞的增殖。 在各濃度(10, 50, and 100 µg/mL)(圖. 1)情況下、SMO 處理都抑制了人臍靜脈內皮細胞的增殖。

圖. 1 SMO對VEGF誘導的細胞增殖的作用
SMO對人臍靜脈內皮細胞中的VEGF誘導的酪氨酸磷酸化抑制作用
為了研究SMO是否抑制酪氨酸激酶家族的活性、用抗體將對照組的磷酸化酪氨酸蛋白和VEGF誘導的人臍靜脈內皮細胞溶解液進行免疫沈澱為磷酸酪氨酸、然後使用抗磷酸酪氨酸抗體進行免疫印跡試驗。 免疫沈澱復合物溶解液(圖.2)中橄欖油處理對照組(無VEGF、泳道1)中發現200kDa 左右的磷酸化酪氨酸蛋白、在VEGF(泳道2)對照組、條紋亮度增加明顯、還發現另外三根條紋(45, 35, 和15 kDa左右)。 當人臍靜脈內皮細胞被SMO(泳道3和4)處理後、200-kDa蛋白質顯示濃度依賴式地減少、同時低分子的條紋消失。(圖. 2)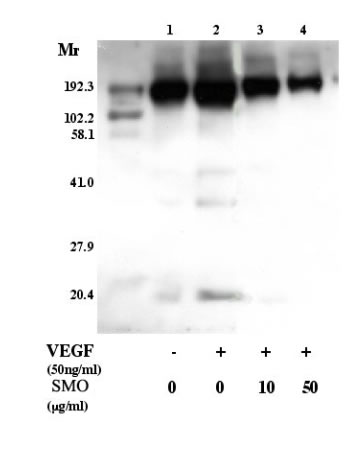
圖. 2 SMO對於VEGF誘導的酪氨酸磷酸化作用
SMO對人臍靜脈內皮細胞中的VEGF受體-2酪氨酸磷酸化抑制作用
當用抗VEGF受體-2抗體(抗-KDR)進行免疫印跡檢測從人臍靜脈內皮細胞得到免疫沈澱的酪氨酸磷酸化蛋白時、在與非VEGF處理對照組的免疫沈澱相比、VEGF處理組明顯誘導了VEGF受體-2的酪氨酸磷酸化。 在本試驗中、只有受體的150-kDa 和200- kDa 形式被發現。 SMO處理過的細胞以濃度依存式的形式明顯抑制了VEGF受體-2的酪氨酸磷酸化(圖. 3)。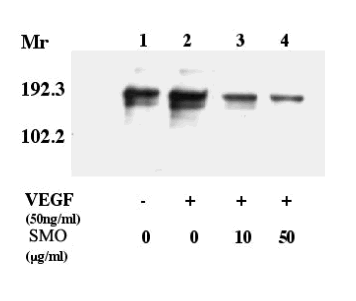
圖. 3 SMO對VEGF誘導的VEGF受體-2(KDR)酪氨酸磷酸化作用
SMO對人臍靜脈內皮細胞中的VEGF受體-1酪氨酸磷酸化抑制作用
當用抗VEGF受體-1抗體(抗- Flt1)進行免疫印跡從人臍靜脈內皮細胞得到免疫沈澱的酪氨酸磷酸化蛋白時、在與非VEGF處理對照組的免疫沈澱相比(圖. 4)、VEGF處理組明顯誘導了VEGF受體-1的磷酸化。 SMO處理過的細胞以濃度依存式的形式明顯抑制了VEGF受體-1的酪氨酸磷酸化(圖. 4)。
圖. 4 SMO對VEGF誘導的VEGF受體-1(Flt1)酪氨酸磷酸化作用
討論
我們先前的研究顯示SMO抑制了許多細胞因子和生長因子(包括FGF-2和VEGF)誘導的促血管生成作用8。 VEGF與細胞表面的至少兩個受體、VEGF受體-1和VEGF受體-2相接合才能產生作用8。 在本試驗中、我們調查了SMO對於VEGF受體的酪氨酸磷酸化的可能作用、使用的是VEGF受體表達細胞株HUVEC。 試驗結果顯示SMO阻斷或抑制了這些細胞株的VEGF誘導的酪氨酸磷酸化。 VEGF通過與VEGF受體-2結合、可以激活細胞外信號調節激酶3。 細胞內區的多酪氨酸殘基的配體誘導的二聚化和受體自身磷酸化可以激活VEGF受體-212。 我們的數據顯示VEGF加快了人臍靜脈內皮細胞的細胞增殖、然而、細胞被SMO處理後、增殖被恢復至最初的未激活狀態(圖. 1)。 VEGF激活了p42/p44絲裂原活化蛋白激酶(mitogen-activated protein kinase)活性、在血管新生過程中這個通道起著重要作用、13VEGF與其受體結合促進了多種成份(包括人臍靜脈內皮細胞內多種分子尺寸如Mr 205、145、120、97和 65–70 kDa的蛋白質)的酪氨酸磷酸化。 在這些蛋白質中、蛋白質Mr 205 kDa與VEGF 受體-1(Flt-1)和受體-2(KDR)有信號聯系14。 VEGF也可以刺激145- kDa 磷酯酶C-γ、對VEGF而言這是壹個重要的細胞分裂信號機理15。 VEGF-依賴性內皮細胞存活部分受磷脂酰肌醇3激酶(phosphatidylinositol 3- kinase)調控12,14。 我們的數據顯示VEGF極強促進了人臍靜脈內皮細胞內的酪氨酸磷酸化、SMO處理組明顯阻斷或降低了酪氨酸磷酸化的程度(圖. 2)。 人臍靜脈內皮細胞表達了高程度的VEGF受體-216,17。 我們的數據顯示SMO處理組明顯抑制了人臍靜脈內皮細胞內VEGF受體-2的酪氨酸磷酸化(圖. 3)。 我們也發現SMO處理組抑制了這些細胞的VEGF受體-1(Flt-1)的酪氨酸磷酸化(圖. 4)。 VEGF受體-1(Flt-1)也是酪氨酸激酶家族的壹種跨膜受體、在人臍靜脈內皮細胞內被表達。 受體-2-表達細胞顯示VEGF促進了細胞形態分析、actin重組、胞膜邊緣波動、趨化作用和絲裂原活性的巨大變化、而VEGF受體-1-表達細胞去缺乏這些反應3,5,18。 VEGF受體-2被發現擔負未受損傷細胞的配體誘導自身磷酸化、在VEGF誘導下兩個VEGF受體在試管試驗中均被磷酸化、而VEGF受體-2比VEGF受體-1調整更迅速5。參考文獻
- Risau W: Mechanisms of angiogenesis. Nature 1997;386:671–674.
- Ferrara N: Role of vascular endothelial growth factor in the regulation of angiogenesis. Kidney Int 1999;56:794–814.
- de Vries C, Escobedo JA, Ueno H, Houck K, Ferrara N, Williams LT: The fms-like tyrosine kinase, a receptor for vascular endothelial growth factor. Science 1992;255:989–991.
- Terman BI, Dougher-Vermazen M, Carrion ME, Dimitrov D, Armellino DC, Gospodarowicz D, Bohlen P: Identification of the KDR tyrosine kinase as a receptor for vascular endothelial cell growth factor. Biochem Biophys Res Commun 1992;187: 1579–1586.
- Waltenberger J, Claesson-Welsh L, Siegbahn A, Shibuya M, Heldin CH: Different signal transduction properties of KDR and Flt1, two receptors for vascular endothelial growth factor. J Biol Chem 1994;269:26988–26995.
- McMahon G: VEGF receptor signalling in tumor angiogenesis. Oncologist 2000;5(Suppl 1):3–10.
- Davis PF, Yi H, Furneaux RH, Johnston PS, Rüger BM, Slim GC: Inhibition of angiogenesis by oral ingestion of powdered shark cartilage in a rat model. Microvasc Res 1997;54:178–182.
- Yuan L, Yoshida M, Davis PF: Inhibition of pro-angiogenic factors by a lipid-rich shark extract. J Med Food 2006;9:300–306.
- Soker S, Gollamudi-Payne S, Fidder H, Charmahelli H, Klagsburn M: Inhibition of vascular endothelial growth factor (VEGF)- induced endothelial cell proliferation by a peptide corresponding the exon 7-encoding domain of VEGF 16S. J Biol Chem 1997; 272:31582–31588.
- Mosmann T: Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods 1983;65:55–63.
- Brekken RA, Overholser JP, Stastny VA, Waltenberger J, Minna JD, Thorpe PE: Selective inhibition of vascular endothelial growth factor (VEGF) receptor 2 (KDR/Flk-1) activity by a monoclonal anti-VEGF antibody blocks tumor growth in mice. Cancer Res 2000;60:5117–5124.
- Zachary I: VEGF signalling: integration and multi-tasking in endothelial cell biology. Biochem Soc Trans 2003;31:1171–1177.
- Pages G, Milanini J, Richard DE, Berra E, Gothie E, Vinals F, Pouyssegur J: Signaling angiogenesis via p42/p44 MAP kinase cascade. Ann N Y Acad Sci 2000;902:187–200.
- Abedi H, Zachary I: Vascular endothelial growth factor stimulates tyrosine phosphorylation and recruitment to new focal adhesions of focal adhesion kinase and paxillin in endothelial cells. J Biol Chem 1997;272:15442–15451.
- Takahashi T, Shibuya M: The 230 kDa mature form of KDR/Flk- 1 (VEGF receptor-2) activates the PLC-gamma pathway and partially induces mitotic signals in NIH3T3 fibroblasts. Oncogene 1997;14:2079–2089.
- Esser S, Lampugnani MG, Corada M, Dejana E, Risau W: Vascular endothelial growth factor induces VE-cadherin tyrosine phosphorylation in endothelial cells. J Cell Sci 1998;111: 1853–1865.
- Barr MP, Byrne AM, Duffy AM, Condron CM, Devocelle M, Harriott P, Bouchier-Hayes DJ, Harmey JH: A peptide corresponding to the neuropilin-1-binding site on VEGF165 induces apoptosis of neuropilin-1-expressing breast tumour cells. Br J Cancer 2005;92:328–333.
- Yoshiji H, Gomez DE, Shibuya M, Thorgeirsson UP: Expression of vascular endothelial growth factor, its receptor, and other angiogenic factors in human breast cancer. Cancer Res 1996;56: 2013–2016.